En los últimos años, han surgido enfermedades infecciosas mortales, como el Ébola y la COVID-19. Aunque los investigadores han desarrollado una variedad de métodos sofisticados para detectar tales infecciones, los diagnósticos existentes enfrentan muchas limitaciones en costos, tiempos e infraestructura.
En el artículo “Synthetic nanobody-functionalized nanoparticles for accelerated development of rapid, accessible detection of viral antigens“, Chao Wang, investigador del Instituto de Biodiseño y la Escuela de Ingeniería Eléctrica, Informática y Energética de la Universidad Estatal de Arizona (ASU), en conjunto con otros colegas de ASU y colaboradores de la Universidad de Washington (UW), Seattle, describen un método para detectar virus como Virus del Ébola (EBOV) y SARS CoV-2. El estudio se publicó en la revista Biosens Bioelectron y su investigación fue apoyada por la Fundación Nacional de Ciencias de los Estados Unidos y los Institutos Nacionales de Salud de ese país.
La investigación aparece en la edición actual de la revista Biosensors and Bioelectronics. El Dr. Xiahui Chen; Ashif Ikbal de ASU y el Dr. Shoukai Kang de UW son los primeros autores. Mientras que Jiawei Zuo y Yuxin Pan son autores contribuyentes.
Nano2RED
La técnica, conocida como Nano2RED, es un giro inteligente en las pruebas convencionales de alta precisión que se basan en protocolos de prueba complejas y de costosos sistemas de lectura. Los nanosensores en solución (“Nano2” en el nombre) sirven para detectar antígenos de enfermedades en una muestra mediante una simple mezcla. El innovador proceso de lectura rápida y electrónica (“RED“, por la siglas en inglés de Rapid and Electronic Readout process) desarrollado en el laboratorio de Wang, ofrece resultados que son detectables como un cambio de color en la solución de muestra, y registra los datos a través de elementos semiconductores económicos como puede ser: LED y fotodetectores.
Esta tecnología representa un avance significativo en la lucha contra las enfermedades infecciosas. Puede desarrollarse y producir a un costo muy bajo, implementarse en semanas o días después de un brote: y estar disponible con un costo de alrededor de 1 centavo por prueba.
Comparación entre pruebas
En comparación con las pruebas de laboratorio de alta precisión ampliamente utilizadas, como ELISA, Nano2RED es mucho más fácil de usar. No requiere incubación o un lavado de la superficie, marca con tinte o amplificación; y aun así proporciona una sensibilidad 10 veces mejor que prueba ELISA. Además, con el uso de dispositivos semiconductores se puede disponer de un sistema de lectura digital altamente portátil, que se puede desarrollar y producir a un bajo costo, tan sólo de unos pocos dólares. Esto lo hace ideal para uso en laboratorio, clínicas, uso doméstico y control remoto o en lugares con carencia de recursos. Este enfoque se basa en diseños modulares y potencialmente podría usarse para probar cualquier patógeno.
Wang, funciona porque es simple

“Esta tecnología funciona no porque sea compleja, sino porque es simple”, afirma el profesor Wang. “Otra característica única es la naturaleza multidisciplinaria de la biodetección. Una comprensión fundamental de la bioquímica, la fluídica y la optoelectrónica nos ayudó a idear algo así de “simple“.
Wang es investigador en:
- Centro de Biodiseño para Diseño Molecular y Biomimética en ASU
- Escuela de Ingeniería Eléctrica, Informática y Energética de ASU
- Centro de Innovación Fotónica
Un "cuello de botella" en las pruebas
Los epidemiólogos conocen desde hace mucho tiempo la fórmula básica a la hora de enfrentarse a un brote de enfermedad. Para identificar casos y detener el contagio, es necesario desarrollar una prueba o ensayo preciso que pueda identificar la enfermedad; luego realizar frecuentemente pruebas tempranas para evaluar la tasa de propagación e intentar aislar a los infectados.
Desafortunadamente, cuando se ha desarrollado, fabricado y distribuido un nuevo diagnóstico, el brote de la enfermedad a menudo ya está muy extendido y es difícil de contener. Además, las pruebas precisas, incluida la PCR (que puede amplificar niveles diminutos de ácidos nucleicos patógenos a niveles medibles), suelen ser costosas, laboriosas y requieren sofisticadas instalaciones de laboratorio.
La epidemia de Ébola de 2014-2016, aunque se limitó en gran medida a la región de África occidental, se propagó a una velocidad aterradora, provocó el pánico y mató a más de 11 mil personas. La tasa de letalidad del virus, es una de las más altas para cualquier patógeno conocido, puede superar el 90%, según la cepa de la enfermedad. La crisis se vio exacerbada por una combinación de inadecuados sistemas de vigilancia y una deficiente infraestructura de salud pública.
El SARS CoV-2, aunque es menos letal que el Ébola, se ha extendido a todos los países del mundo y ya ha matado a más de 5.6 millones de personas en todo el mundo. En ambos brotes de enfermedades, las pruebas de diagnóstico llegaron en forma tardía a la escena. Además, se han administrado muy pocas, incluso después de su exitoso desarrollo.
En el estudio se aplica un nuevo e innovador método para evaluar estas 2 enfermedades prominentes, como una prueba de concepto.
Oleaje
Una característica común en muchos brotes de enfermedades es la velocidad vertiginosa con la que un patógeno, después de haber infectado primero a un puñado de personas, puede tomar impulso, expandirse en todas direcciones y abrumar rápidamente a hospitales y proveedores de atención médica. Romper las cadenas de transmisión de un patógeno requiere identificar y aislar a las personas enfermas mediante pruebas, y eso debe hacerse lo antes posible.
Durante una pandemia como la de la enfermedad de COVID-19, la sensibilidad de una prueba de diagnóstico determinada, es secundaria a la frecuencia con la que se realiza la prueba y el tiempo que lleva procesar los resultados. Una prueba altamente sensible tiene un uso limitado si sólo se puede administrar una vez y los resultados requieren un tiempo de respuesta de semanas. Las investigaciones han demostrado que los brotes de infección se controlan mejor cuando las pruebas se repiten en intervalos de menos de 3 días y a gran escala.
Preparar adecuadamente a la sociedad para los brotes actuales y futuros de enfermedades infecciosas requerirá diagnósticos más rápidos, más baratos, más precisos y más fáciles de usar.
Afinidad
Esta nueva tecnología puede identificar la glicoproteína secretada (sGP), que es como una “huella dactilar” que indica la enfermedad del virus del Ébola y el dominio de unión al receptor de la proteína del pico del SARS-CoV-2 (RBD). La tecnología es altamente precisa y rivaliza con la tecnología ELISA, que es reconocida como un estándar de oro desde hace mucho tiempo para las pruebas de diagnóstico.
La idea básica de tales diagnósticos, conocidos como inmunoensayos, es simple: se aplica una muestra de sangre (u otro fluido biológico) al ensayo, que se adorna con anticuerpos. Cuando los anticuerpos reconocen la presencia de un antígeno de la enfermedad correspondiente en la muestra, se unen a él y producen un resultado positivo en la prueba. En la prueba ELISA, el antígeno de la enfermedad debe inmovilizarse en una superficie plana.
El diagnóstico positivo en la Nano2RED se basa en la afinidad de unión, pero en su lugar usa nanopartículas de oro flotantes para la lectura. A diferencia de ELISA, la Nano2RED puede desarrollarse desde cero en aproximadamente 10 días y, en teoría, es aplicable a cualquier patógeno. Esto proporciona una vigilancia temprana de vital importancia en el caso de un brote de enfermedad. Pueden entregarse los resultados de la prueba en un tiempo de 15 a 20 minutos; y se puede administrar a un costo estimado de un centavo por prueba. En el estudio actual, se demostró que la nueva prueba detecta la sGP de Ébola en suero con una sensibilidad aproximadamente 10 veces mejor que ELISA.
Detección de señales de peligro
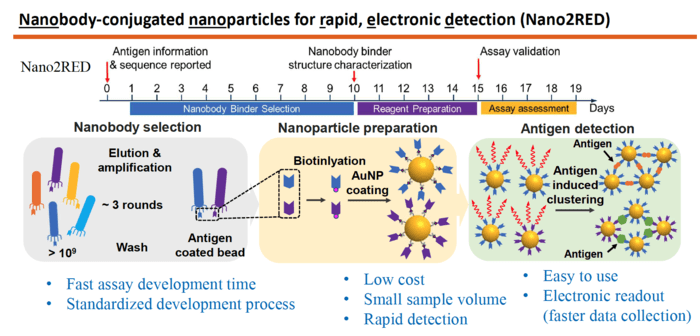
En el gráfico adjunto se muestra el funcionamiento del método:
- El primer paso es producir una biblioteca muy grande que contenga más de mil millones de secuencias de aminoácidos aleatorias conocidas como nanocuerpos, que pueden actuar como anticuerpos sintéticos, capaces de unirse a los antígenos de enfermedades diana.
- Luego, esta amplia biblioteca de nanocuerpos se analiza sucesivamente contra el antígeno en cuestión, por ejemplo, sGP en el caso del Ébola. Solo aquellos nanocuerpos que muestran una fuerte afinidad de unión por el antígeno se utilizan para la detección.
- A continuación, los nanocuerpos seleccionados se fijan a nanopartículas de oro que actuarán como sondas para identificar y unirse a los antígenos presentes en una muestra de sangre. En el estudio, se seleccionaron un par de 2 nanocuerpos de alta afinidad y se unieron a nanopartículas de oro. Este enfoque mejora la sensibilidad y la especificidad de la prueba.
La innovación más importane de Nano2RED es la forma en que se registra la detección de antígenos. A medida que los nanocuerpos reconocen los antígenos de la enfermedad en la muestra, se unen y forman grupos de nanocuerpos y antígenos unidos, como islas de algas que flotan en la superficie del mar. “Básicamente, un antígeno funciona como superpegamento para unir las nanopartículas”, afirma Wang.
Una oportunidad “dorada” para la lucha contra las enfermedades infecciosas
Las nanopartículas de oro proporcionan una plataforma estable para mantener los nanocuerpos en su lugar. Una vez que se ha producido una unión suficiente, los “racimos unidos” comienzan a hundirse hasta el fondo del recipiente. Esto se puede detectar a simple vista en la forma de un cambio de color. La solución adquiere un color más claro a medida que se precipitan los grupos de antígenos y anticuerpos transportados por nanopartículas de oro, lo que indica la detección del patógeno.
Si bien la precipitación completa de los grupos de nanopartículas que conducen a un resultado de prueba normalmente puede demorar varias horas, el proceso se puede acelerar centrifugando la muestra, lo que elimina el tiempo de espera para la precipitación. En este caso, solo 15-20 minutos son suficientes para obtener un resultado. “Por supuesto, las nanopartículas de oro son pesadas y eso también ayuda a una rápida sedimentación”, señaló Wang.
Las nanopartículas de oro también funcionan para mostrar color, no amarillo sino rojo aquí, al absorber la luz de un rango espectral estrecho. Esta función de absorbencia permitió al laboratorio de Wang inventar un económico y diminuto dispositivo que convierte este cambio de color en una señal eléctrica, usando fotodetectores y LED semiconductores de combinación de colores. Dichos instrumentos producen una lectura rápida y precisa de los resultados del ensayo, cuyos límites de detección son comparables o mejores que los costosos métodos de espectroscopia de laboratorio.
La prueba también ofrece resultados cuantitativos basados en la cantidad de antígeno detectado. Esto podría ser de vital utilidad para estimar la gravedad de la enfermedad; así como el tiempo transcurrido desde el evento de infección. En el futuro, los resultados de las pruebas pueden digitalizarse mediante circuitos y transmitirse convenientemente a través de Internet a cualquier parte del mundo para ser usadas en análisis de datos y con un mayor escrutinio. Esto podría ser importante para los procesos de toma de decisiones de políticas gubernamentales y la interrupción oportuna de la transmisión.
La Nano2RED requiere solo una pequeña muestra de sangre, normalmente alrededor de 20 microlitros. “Esto también hace que el oro sea económico en nuestro caso, porque la cantidad que necesitamos es muy pequeña”, dijo Wang. A diferencia de los métodos convencionales, Nano2RED también es muy sencilla de usar y requiere una capacitación mínima para el personal de atención médica. No se requiere de ninguna incubación, lavado, etiquetado fluorescente o amplificación que hace de estos procesos algo costoso y que consumen mucho tiempo.
Nuevas investigaciones podrían ayudar a mejorar aún más los límites de detección del ensayo y modificar sus capacidades de detección para incluir:
- Partículas de virión -fragmentos de virus-
- Vesículas extracelulares
- Moléculas pequeñas
- Ácidos nucleicos
“Ciertamente, todavía hay mucho por explorar”, agregó Wang, “pero hasta el momento vivimos un feliz matrimonio entre las disciplinas de ingeniería y la biología. Y eso es en lo que seguiremos trabajando”.
Referencias
- Xiahui Chen, Shoukai Kang, Md Ashif Ikbal, Zhi Zhao, Yuxin Pan, Jiawei Zuo, Liangcai Gu, Chao Wang; Synthetic nanobody-functionalized nanoparticles for accelerated development of rapid, accessible detection of viral antigens; Biosens Bioelectron; Publicado en línea el 6 de enero de 2022; 202:113971; DOI: 10.1016/j.bios.2022.113971; Disponible en el URL: https://www.sciencedirect.com/science/article/pii/S0956566322000100