Un nuevo estudio experimental publicado en la revista Nature informa sobre un nuevo antibiótico que se une al ribosoma de las células bacterianas y evita que los patógenos resistentes a los medicamentos enfermen a los ratones.
El estudio, en coautoría de investigadores de la Universidad de Illinois en Chicago (UIC), no solo demuestra el potencial del fármaco, llamado iboxamicina, para algún día ayudar a los seres humanos que están enfermos debido a bacterias resistentes a los antibióticos, sino que también identifica cómo el fármaco supera en la mayoría de los casos, al mecanismo generalizado de resistencia a esta clase de antibacterianos.
Oxepanoprolinamida sintética
El fármaco, una oxepanoprolinamida sintética, que es una nueva clase de fármacos antibacterianos, fue desarrollado y probado en animales por los coautores del estudio de la Universidad de Harvard.
El estudio publicado en Nature, “Una clase de antibióticos sintéticos que supera la resistencia a múltiples fármacos bacterianos” [1], informa que la iboxamicina fue poderosamente eficaz al combatir las bacterias gramnegativas y gram positivas resistentes a los medicamentos en modelos de ratón.
Mecanismo que permite superar la resistencia
El estudio también informa sobre el descubrimiento de la UIC: el mecanismo molecular que permite que este fármaco supere la resistencia, información importante que la comunidad científica puede utilizar para tomar decisiones mejor informadas al buscar y desarrollar nuevos antibióticos y diseñar estudios para probarlos.
“Fue emocionante ver a este agente unido a la estructura de un ribosoma resistente a los fármacos, y fue bastante sorprendente que el fármaco se una exactamente de la misma manera que el ribosoma normal, pero provoca cambios estructurales significativos que nunca se han observado antes o que podría predecirse a partir de los datos existentes”, menciona el coautor correspondiente del estudio, Yury Polikanov, profesor asociado de ciencias biológicas de la UIC en la Facultad de Artes y Ciencias Liberales y profesor asociado de ciencias farmacéuticas en la Facultad de Farmacia.
Visualización de ribosomas
En investigaciones anteriores, Polikanov desarrolló un enfoque único para visualizar ribosomas que son resistentes a los antibióticos convencionales. A través de este proceso, él y Alexander Mankin, profesor de ciencias farmacéuticas de la UIC, informaron en el artículo “Structure of Erm-modified 70S ribosome reveals the mechanism of macrolide resistance” [2] en Nature Chemical Biology de enero de 2021 que la metilación, un proceso de cambio de la composición química de un nucleótido en el sitio de unión del fármaco ribosómico, da como resultado la incapacidad de que dichos ribosomas se unan a algunos antibióticos clínicamente importantes que hacen que dichos ribosomas sean resistentes a los fármacos.
Encontrando una pieza que encaja
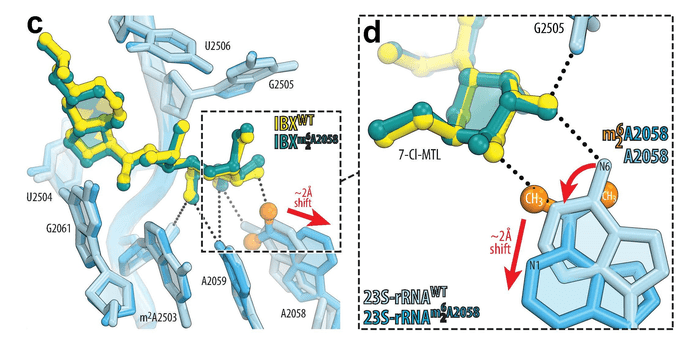
Para entender cómo y por qué la iboxamicina logra superar la resistencia, Polikanov y el estudiante graduado de la UIC, Egor Syroegin -coautor del estudio-, aplicaron sus técnicas de visualización únicas. Los investigadores de la UIC co-cristalizaron ribosomas bacterianos con el fármaco y congelaron los cristales. Luego, utilizaron una poderosa radiografía en las instalaciones de Advanced Photon Source en el Laboratorio Nacional Argonne del Departamento de Energía de Estados Unidos para determinar el patrón de difracción -desviación de una onda al chocar con el borde de un cuerpo opaco o al atravesar una abertura- de la molécula, los lugares donde la radiación rebota en los átomos de los cristales. Este patrón se utilizó para calcular mapas de densidad electrónica del complejo ribosoma-fármaco y visualizar sus interacciones.
“Todo el proceso de la determinación de la estructura atómica mediante rayos X es como un rompecabezas en 3D“, dijo Polikanov. “Identificamos el lugar abierto en el rompecabezas del ribosoma, y solo necesitábamos encontrar la pieza del medicamento que encajara. Una vez que hicimos eso, pudimos ver dónde y cómo el fármaco estaba unido al ribosoma“.
La importancia del simple ensayo y error
Cuando los investigadores de la UIC observaron su visualización del fármaco de Harvard interactuando con el ribosoma resistente al fármaco, encontraron algo inesperado.
“Notamos que el mecanismo de resistencia más común a través de la metilación del ribosoma no funciona contra este nuevo fármaco porque todavía se une al ribosoma metilado y evade este tipo de resistencia. También hemos notado que la iboxamicina en realidad hizo que el nucleótido metilado en el corazón del ribosoma y justo en el sitio de unión del fármaco, se apartara del camino del fármaco, de modo que tanto el fármaco como el nucleótido metilado en el ribosoma resistente al fármaco pueden co- existir – esto fue totalmente inesperado y sin precedentes”, asegura Polikanov.
“Esto nos muestra que la madre naturaleza es mucho más inteligente que nosotros. Ciertamente, existe un lugar para el diseño racional de medicamentos, pero no podemos olvidar la importancia del simple ensayo y error“, dijo. “Ni el espectro de actividad de la iboxamicina, ni su potencia en cepas resistentes, podrían haberse predicho a partir de conocimientos previos“.
Referencias
- Matthew J. Mitcheltree, Amarnath Pisipati, Egor A. Syroegin, Katherine J. Silvestre, Dorota Klepacki, Jeremy D. Mason, Daniel W. Terwilliger, Giambattista Testolin, Aditya R. Pote, Kelvin J. Y. Wu, Richard Porter Ladley, Kelly Chatman, Alexander S. Mankin, Yury S. Polikanov y Andrew G. Myers; A synthetic antibiotic class overcoming bacterial multidrug resistance; Nature; Publicado el 27 de octubre de 2021; DOI 10.1038/s41586-021-04045-6; Disponible en el URL: https://www.nature.com/articles/s41586-021-04045-6
- Svetlov, M.S., Syroegin, E.A., Aleksandrova, E.V. et al. Structure of Erm-modified 70S ribosome reveals the mechanism of macrolide resistance. Nat Chem Biol 17, 412–420 (2021). DOI: 10.1038/s41589-020-00715-0; Disponible en el URL: https://www.nature.com/articles/s41589-020-00715-0